|
二.碳负离子的结构
碳负离子带有负电荷,中心碳原子为三价,价电子层充满八个电子,具有一对未共用电子。中心碳原子的可能构型有两种:一种为 杂化的平面构型,另一种 杂化的平面构型,另一种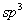 杂化的棱锥构型。 杂化的棱锥构型。

 杂化 杂化
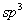 杂化 杂化
不同的碳负离子由于中心碳原子连接的基团不一样,其构型不尽相同,但一般简单的烃基负离子是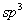 杂化的棱锥构型,未共用电子对处于 杂化的棱锥构型,未共用电子对处于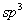 杂化轨道。这主要因为 杂化轨道。这主要因为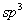 杂化轨道与 杂化轨道与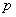 轨道比较,轨道中包含更多的 轨道比较,轨道中包含更多的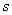 轨道成分,而轨道中 轨道成分,而轨道中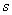 成分的增加意味着轨道更靠近原子核,轨道的能量降低。当碳负离子的未共用电子对处于 成分的增加意味着轨道更靠近原子核,轨道的能量降低。当碳负离子的未共用电子对处于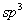 杂化轨道时,与处于 杂化轨道时,与处于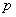 轨道比较,未共用电子对更靠近碳原子核,因此,体系能量较低,比较稳定。同时,在碳负离子体系中,未共用电子对与其他三对成键电子之间也存在斥力,当未共用电子对处于 轨道比较,未共用电子对更靠近碳原子核,因此,体系能量较低,比较稳定。同时,在碳负离子体系中,未共用电子对与其他三对成键电子之间也存在斥力,当未共用电子对处于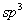 杂化轨道时,与其他三对成键电子所处的轨道之间近似 杂化轨道时,与其他三对成键电子所处的轨道之间近似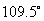 ,而处于 ,而处于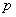 轨道时,则与三个 轨道时,则与三个 杂化轨道之间为 杂化轨道之间为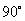 。因此,处于 。因此,处于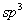 杂化状态的棱锥构型,电子对的排斥作用较小,比较有利。所以与碳正离子不同,一般简单的烃基碳负离子是处于 杂化状态的棱锥构型,电子对的排斥作用较小,比较有利。所以与碳正离子不同,一般简单的烃基碳负离子是处于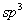 杂化状态的棱锥构型,未共用电子对处于四个 杂化状态的棱锥构型,未共用电子对处于四个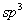 杂化轨道中的一个,这是碳负离子通常的合理结构。 杂化轨道中的一个,这是碳负离子通常的合理结构。
虽然环丙基正离子由于环张力不利于平面构型而很不稳定,但环丙基负离子确是存在的,因为棱锥构型对碳负离子是相对有利的。

在桥环化合物中,桥头碳正离子是很不稳定的,因为环的几何形状的
限制,不利于平面构型的存在,所以很少有桥头碳正离子生成。但对桥头碳负离子说,棱锥构型则是相对有利的,所以桥头碳负离子是稳定的,可以存在的。
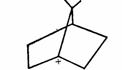
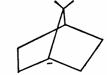
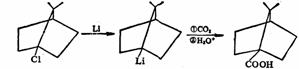
正因如此,桥头有机锂化合物容易生成,例如下面通过桥头碳负离子进行的反应是很顺利的。这也为碳负离子的棱锥构型提供了进一步的证据。
但当带负电荷的中心碳原子与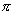 键或芳环相连时,由于未共用的电子对能与 键或芳环相连时,由于未共用的电子对能与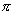 键发生共轭离域而稳定,这时碳负离子将取 键发生共轭离域而稳定,这时碳负离子将取 杂化的平面构型,以达到轨道最大的交盖,更好地离域,使体系能量最低最稳定。例如: 杂化的平面构型,以达到轨道最大的交盖,更好地离域,使体系能量最低最稳定。例如:
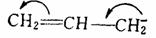
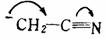

三.碳负离子的稳定性
影响碳负离子稳定性的原因无非是结构和溶剂等主要因素,这种影响主要表现在两个方面,一方面表现在碳负离子是否容易生成,与碳原子相连的氢原子是否容易离去,即酸性的强弱;另一方面表现为生成的碳负离子是否稳定。
1.杂化效应
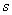 轨道与相应的 轨道与相应的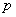 轨道比较更靠近原子核,处于较低的能级,这种差别也表现在杂化轨道中,在杂化轨道中 轨道比较更靠近原子核,处于较低的能级,这种差别也表现在杂化轨道中,在杂化轨道中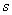 轨道成分越多,则轨道相应越靠近原子核,能级也越低。因此,在C—H键中,一对成键电子处于不同杂化轨道时, 轨道成分越多,则轨道相应越靠近原子核,能级也越低。因此,在C—H键中,一对成键电子处于不同杂化轨道时,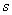 轨道成分越多,电子对靠碳原子核越近,被碳原子核拉得越紧,氢原子质化的趋势也就越大。例如在烷、烯、炔中,与不同杂化状态的碳原子相连的氢原子质子化离去的难易程度,即酸性的强弱是不同的,所生成的碳负离子的稳定性也不同。而相应碳负离子稳定性的次序为: 轨道成分越多,电子对靠碳原子核越近,被碳原子核拉得越紧,氢原子质化的趋势也就越大。例如在烷、烯、炔中,与不同杂化状态的碳原子相连的氢原子质子化离去的难易程度,即酸性的强弱是不同的,所生成的碳负离子的稳定性也不同。而相应碳负离子稳定性的次序为:
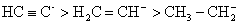
这种由于中心碳原子杂化状态的不同,对碳负离子的稳定性产生的不同影响称为杂化效应。因为这种不同的影响是由于杂化轨道中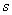 轨道成分的不同所造成的,所以也叫 轨道成分的不同所造成的,所以也叫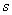 -性质效应。 -性质效应。
2.电子效应
当反应物分子中碳原子上连有强的吸电基时,由于吸电的诱导效应,使碳原子上所连的氢酸性增强,容易质子化离去而形成碳负离子。同样,当生成的碳负离子在中心碳原子上连有强的吸电基时,也可以分散负电荷,而使碳负离子稳定。
相反,当碳原子上连有供电基时,由于供电诱导效应的影响,与碳原子相连的氢原子质子化趋势变小,酸性减弱,生成的碳负离子其负电荷难于分散,稳定性减小。例如:
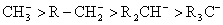
当碳负离子中带有负电荷的中心碳原子与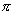 键直接相连时,由于未共用电子对与 键直接相连时,由于未共用电子对与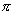 键共轭,电子离域的结果,使碳负离子得到稳定。 键共轭,电子离域的结果,使碳负离子得到稳定。
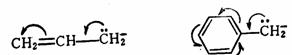
而且连接的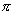 键(或苯环)越多则离域越充分,碳负离子越稳定。 键(或苯环)越多则离域越充分,碳负离子越稳定。
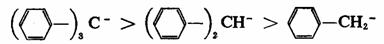
碳-氮、碳-氧和氮-氧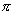 键与负碳离子的中心碳原子直接相连时,也有同样的影响,而且由于氮和氧与碳比较具有较大的电负性,能更好地分散负电荷,所以更能使碳负离子稳定。例如: 键与负碳离子的中心碳原子直接相连时,也有同样的影响,而且由于氮和氧与碳比较具有较大的电负性,能更好地分散负电荷,所以更能使碳负离子稳定。例如:
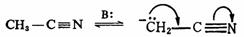
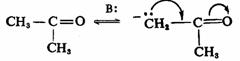
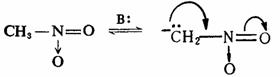
3.芳香性
环状碳负离子是否具有芳香性,对其稳定性也有明显影响,如环戊二烯的酸性(p )比一般烯烃的酸性(p )比一般烯烃的酸性(p )要大得多,当然这与环戊二烯中存在超共轭的影响有关,但更重要的是因为环戊二烯负离子符合Hückel规则,具有芳香性所致。环壬四烯负离子和环辛四烯两价负离子与上述情况类似,也具有芳香性,因而也是较稳定的碳负离子。 )要大得多,当然这与环戊二烯中存在超共轭的影响有关,但更重要的是因为环戊二烯负离子符合Hückel规则,具有芳香性所致。环壬四烯负离子和环辛四烯两价负离子与上述情况类似,也具有芳香性,因而也是较稳定的碳负离子。
4.溶剂效应
在所有涉及到的离子反应里,溶剂对参与反应的离子的稳定化作用是非常明显的。在没有溶剂的情况下,离子反应在气相进行是需要很高的能量的,一般在气相更普遍的是按自由基反应进行。如HCl在气相解离为自由基只需要430.95kJ/mol的能量,而解离为离子则能量必须达到1393.27kJ/mol,若在极性溶剂(如水)中,HCl很容易解离为离子,可见溶剂效应对离子的稳定化作用是重要的。
一般说,极性的质子溶剂如水,能够有效地溶剂化正离子和负离子。其中正离子是通过与溶剂分子的未共用电子对偶极作用溶剂化,而负离子则通过氢键作用溶剂化。极性的非质子溶剂如二甲基亚砜(DMSO),其结构式为:
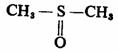
它虽然在能够溶剂化正离子,但并不能有效地溶剂化负离子,因为没有活泼氢可以形成氢键,这样,负离子在极性非质子溶剂中将更为活泼。所以,如选择不同的溶剂,往往可以直接影响负离子的活泼性。
共 2 页
1 2
上一节
下一节
|