|
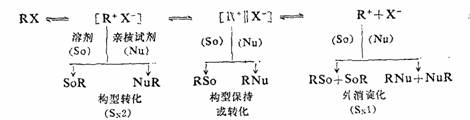
二.亲核取代反应的“离子对—溶剂化”学说
立体化学实验结果表明,百分之百的外消旋化和百分之百的构型转化都是很少见的,即典型的SN1和典型SN2历程都是不多的,SN1和SN2历程是亲核取代反应历程中的两种极限情况。多数的情况下,在SN1历程中,外消旋化的同时,通常伴随着构型的转化;在SN2的历程中,构型转化的同时,往往伴随部分外消旋作用。对于这种现象,曾提出过多种“理论”进行解释。例如对SN1历程中出现不同
程度的构型转化产物,可用“屏蔽效应”进行解释。最新的并且得到一些实验事实支持的理论为“离子对—溶剂化”学说。
无机盐在介电常数较小的溶剂中能形成离子对早已由实验证明。同样,有机物在极性溶剂中离解成正负离子的过程中也生成离子对。溶剂对有机反应历程的影响已为很多人重视。反应物与溶剂的作用叫做溶剂化。“离子对—溶剂化”学说认为中性分子R—L在极性溶剂中离子化溶剂化是分步进行的。第一步是电离,即共价键发生异裂,生成带相反电荷的正负离子,两者靠在一起,形成紧密离子对,周围是溶剂分子,使之与别的离子对隔离开来。第二步是少数溶剂进入正、负离子之间,把它们在一定程度上分隔开来,但两个带相反电荷的离子仍然是一个离子对,叫做溶剂介入(或分隔)离子对。在第三步中,带不同电荷的离子完全被溶剂分子包围,形成溶剂化的正离子和负离子。这种离子化和溶剂化的过程可用下列方程式表示。

如果在中性分子R—L中与L相连的是碳手性碳原子,在紧密离子对和溶剂介入离子对中,R+仍保持手性,而在溶剂化的碳正离子中,中心碳原子是SP2杂化,R+是平面构型,所以R+失去手性。在离子化—溶剂化的过程中的三步反应都是可逆的,各步速度常数K的大小取决于化合物的结构和溶剂的性质。
“离子对—溶剂化”学说认为:亲核取代反应是一个连续统一体的概念,即在化学反应过程中反应物是不断变化的。如果SN反应发生在溶剂化的第一步,则溶剂或Nu:只能从背面进攻反应物或紧密离子对,引起构型的转化,是典型的SN2历程。若反应发生在第三步,则产物为外消旋体,反应是典型的SN1历程。反应发生在第二步,则产物的构型部分发生转化。
三.邻基参与
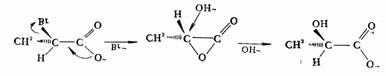
立体化学实验结果表明SN1历程的理想结果为全部消旋化。多数是消旋化的同时,通常是伴随部分构型转化;但在个别情况是构型全部保持。按SN1历程进行的反应,其构型全部保持可分两种情况,一种是碳架不能发生翻转,象某些脂环化合物,桥头碳上发生的取代反应由于碳架的固定,反应后的构型必然保持原来的样子。另一种情况是由于邻近基团的参与,例如,a—溴代丙酸负离子按SN1历程进行碱性水解或醇解时,则产物构型全部保持不变。对这个反应的合理解释是邻基参与,即手性碳原子邻近的—COO-基参与了反应,它从溴原子的背面进攻,生成不稳定的内酯,同时,手性碳原子的构型发生了转化,此步类似分子内的SN2反应;接着,亲核试剂(OH-)再从内酯环的背面,也就是从原来溴原子离去的方向引入,手性碳原子的构型再发生一次转化。由于手性碳经过两次转化,其结果等于构型不变,即100%保持原来的构型。
在定速步骤中若有邻基参与,则反应速度显著增加。邻基参与使反应速度加快的现象称为邻基促进或邻助效应。例如,对甲苯磺酸-反-4-甲氧基环己酯的乙酸解反应,由于甲氧基参与的结果,反应速度比其顺式异构体快6倍,同时生成反式乙酸酯,这意味着构型保持。在这种情况下,反式异构体以船式构象通过CH3O-的氧进攻Ots所在的碳原子,帮助其离去,同时生成双环氧鎓离子中间体,随后CH3CO2-从背面进攻C1或C4,则生成产物。
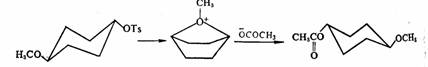
反式构型在反应过程中存在邻助效应
可见邻基参与的条件之一是邻近基团(不一定是邻位)处于适当位置(离去基团的反位)。邻基参与反应在多官能团化合物可以常常见到,一个是离去基团,另一个是邻近的亲核性基团。它必须处于适当的位置(或靠单键自由旋转,转到适当位置)能参与亲核反应。若反应物分子中心碳原子邻近有-COO-、-O-、-OH、-OR、-NR2、-X、-Ph、CH=CH2、一C-等基团,且空间距离适当
,这些基团就可靠它们的电荷或未共用电子对参与分子内的亲核取代反应、反应结果除使构型保持外,通常还可以导至环状化合物的形成。
本节共 3 页
1
2
3 |