|
特殊结构的酯和某些第三醇酯,按AAC1和AAL1历程或BAL1历程进行。例如,2,4,6-三甲基苯甲酸酯,由于邻位两个甲基的位阻作用,在一般条件下很难水解。但将它溶解在硫酸中,然后倾入冰水中,即得2,4,6-三甲基苯甲酸,按AAC1历程(酸催化,酰氧键断裂,单分子历程)水解。
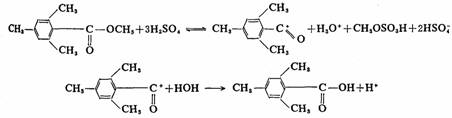
第三醇酯在酸性水解时,由于叔碳正离子比较容易生成,水解反应按AAL1历程((酸催化,烷氧键断裂,单分子历程)水解。
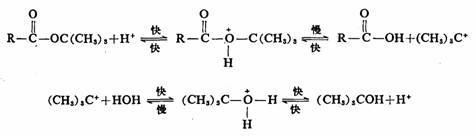
根据微观可逆性原理,酯水解的逆反应即酯化反应应按相应的历程进行。
4.影响羰基活性的主要因素
不管在那类亲核加成反应中,反应的定速步骤都是Nu-进攻羰基碳原子这一步,影响亲核加成反应活性的主要是羰基化合物的结构。从电子效应来看,羰基碳原子连有给电子基时,羰基碳的电子云密度降低,羰基活性也降低;从空间效应来看,羰基碳原子所连基团体积增大时,在反应的定速步骤中,羰基碳原子由SP2杂化转变为SP3杂化,基团变得更加拥挤,不利于反应的进行。不同羰基化合物羰基碳原子活性次序是:
RCHO>RCOCH3>RCOR>C6H5COR
下表是一些羰基化合物与亚硫酸氢钠的加成产率(反应1h,%),羰基的活性越强,加成产率越高。
CH3CHO
88.7
RCHO 70.9
CH3COCH3
56.2
CH3CH2COCH3
36.4
(CH3)2CHCOCH3
12.3
(CH3)3CCOCH3
5.6
C6H5COCH3
1
羧酸衍生物的加成—消除反应,离去基团L对反应活性影响很大。对RCOCl来说,Cl的强的拉电子作用和较弱的P-π共轭,羰基碳的电子云密度增大,有利于亲核试剂的进攻,同时Cl又是易离去基团,因此酰氯表现出很高的反应活性。相反对RCONR2来说,氮的弱吸电子作用和较强的P-π共轭,以及NR2-的强碱性,使酰胺的活性很低。羧酸衍生物的加成—消除反应的活性次序是:
RCOCl>(RCO)2O>RCOOR>RCONR2
二.共轭加成和插烯规律
碳碳双键和碳氧双键组成的共轭体系起亲核加成反应时,试剂可以进攻羰基碳原子或β-碳原子,后一种方式称为1、4-加成,也称共轭加成。
从共轭加成的最终产物来看,它相当于碳碳双键的亲核加成。HCN、RMgX及某些在碱性条件下能形成碳负离子的物质(如含活泼亚甲基的化合物)均可进行共轭加成,而且在合成上有着实际意义。从结构上讲,羰基附近位阻较大时有利于1、4-加成而不利于1、2-加成。
亲核试剂不与典型的碳碳双键起加成反应,由于碳碳双键与羰基共轭的结果,羰基对碳碳双键产生了巨大的影响,所以亲核试剂才与碳碳双键上的碳起亲核加成反应。有时也把碳碳双键与羰基的共轭体系称为大羰基,这样β-碳就成了大羰基上的碳原子,因此具有较强的正电中心,Nu:自然就可以进攻β-碳原子了。例如:
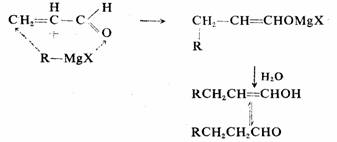
碳负离子的共轭加成反应称为麦克尔(Michael)反应。麦克尔反应被碱催化,其作用是产生碳负离子。最常用的碳负离子可能的来源是丙二酸酯、乙酰乙酸乙酯、氰乙酸酯、硝基化合物等。例如:
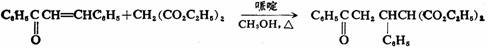
麦克尔反应是制备1,5-二羰基化合物的有用方法,在有机合成上有重要用途。例如5,5-二甲基-1,3-环己二酮,俗称双甲酮的合成:
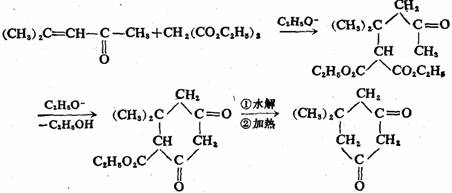
5,5-二甲基-1,3-环己二酮(双甲酮)
麦克尔反应的反应历程如下:
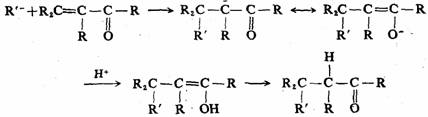
羰基(或其他含不饱和键的吸电子的官能团)对α—氢的活化作用可以通过共轭体传至更远的地方。例如在CH3—CHO之间插入一个CH=CH成为CH3-CH=CH-CHO共轭体系后,CH3和CHO之间相互影响依然存在,CH3上的H仍然具有活泼性。2—丁烯醛为乙醛的插烯物,象这样在化合物A—B的A和B之间插入一个或多个—CH=CH—转变成A—(CH=CH—)nB型化合物后,原来A和B之间相互影响依然存在的现象,非常普遍,称为“插烯作用”或“插烯规律”。
本节共 3 页
1
2
3 |