实验指出,在不同的温度和压强范围,一个单元系可以分别处于气相、液相或固相,有些物质的固相
还可以具有不同的晶格结构,不同的晶格结构也是不同的相,这些相可以相图上表示出来。 1. 相图的定义
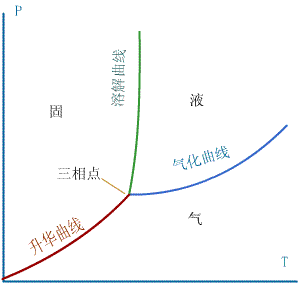 在 P-T 图上,直观它们所处的条件的关系,这样的几何图形叫相图。
2. 相图的一般结构
a. 三个相所在区: 固态( P 大, T 低),液态( P 大, T 较高),气态( P 小)
b. 分隔固态、液态、气态这三个区的三条线:在相图上,固态、液态、气态之间的边界线为三条曲
线。系统的状态处在这三条线上时,可以两相共存,如分隔固气两相的曲线叫升华曲,线当系统的状
态在升华线上时可以固气共存;分隔固液两相的曲线叫熔解曲线,当系统的状态在熔解曲线上时,可
以固液共存;分隔液气两相的曲线叫汽化曲线,当系统的状态在汽化线上时,可以液气共存。 c. 三相点:汽化线、溶解线、升华线交于一点,这一点叫三相点,当系统的状态处在该点上时,可
以固、液、气三相共存。水的三相点 T =273.16 , P =610.9Pa 。 d. 临界点:当系统的温度足够高时,无论压强多大也不能使系统处于液态,所以汽化线有一个终点
C ,系统的温度高于 C 点的温度时,液相不存在,所以汽化线也不存在, C 点叫临界点。 水的临界温度 647.05k ,临界压强 22.09 × 10 6 Pa |
![]()